学会・研究会トピックス
ベーチェット病の新規の疾患感受性遺伝子および発症メカニズムを解明
竹内正樹特任助教と水木信久主任教授、目黒明特任講師らは、厚生労働省の特定疾患(難病)の一つであるベーチェット病を対象とした過去最大規模の遺伝子解析研究をアメリカ国立衛生研究所、トルコ・イスタンブール大学などと共同で行い、ベーチェット病の遺伝要因(疾患感受性遺伝子)および発症メカニズムを詳細に解明しました。
ベーチェット病は原因不明の全身性炎症性疾患で、長期間にわたり再発と寛解を繰り返し、重症例では眼病変によって失明に至ることもあります。本研究により、ベーチェット病の疾患感受性遺伝子として新たに「IL1A-IL1B」、「RIPK2」、「ADO-EGR2」、「LACC1」、「IRF8」、「CEBPB-PTPN1」領域が同定されました。また、同定した遺伝子の機能解析により、IL1A-IL1BのSNP*1のリスクアリル*2を2個保有する人においてIL-1βが増加し、またIL-1αが低下していることが明らかになりました。このことから、IL-1αの皮膚バリア機能の低下によって、侵入した病原体への過剰なIL-1βを介した免疫反応がベーチェット病の発症メカニズムに関与することが示唆されました。さらに、本研究において同定された疾患感受性遺伝子の多くが、炎症性腸疾患であるクローン病や、感染症であるハンセン病と共通することが分かりました。これらの成果により、ベーチェット病の疾患感受性遺伝子や発症メカニズムが解明されただけでなく、将来的には個人の遺伝情報に基づいた、効果的で副作用の少ない新たな治療薬の開発が期待されます。
本研究成果は、主要国際雑誌である「Nature Genetics(ネイチャー・ジェネティクス)」に掲載されました。それを受け、2017年2月6日に厚生労働記者会にて記者会見を開き、テレビ朝日、読売新聞、日本経済新聞、時事通信など多くのメディアで報道されました。

厚生労働省記者会にて(2017年2月6日)
研究の背景
ベーチェット病は我が国の特定疾患(難病)の一つであり、難治性口内炎、ぶどう膜炎、陰部潰瘍、皮膚病変を4主症状とする原因不明の難治性炎症性疾患です。再発と寛解を繰り返し、重症例では眼の網膜が不可逆的なダメージを受け失明に至ることもあります。ベーチェット病は、北緯30度から45度の地中海沿岸諸国(トルコなど)、中近東諸国(イランなど)、東アジア(日本など)に好発し、この地理的特徴からシルクロード病とも呼ばれています。ベーチェット病の発症には遺伝要因と環境要因の両方が関与していることが以前より考えられており、ベーチェット病の最も強い遺伝要因としてHLA-B*51が知られています。しかしながら、ベーチェット病の発症メカニズムは未だ明確ではないため、それに関与する遺伝要因と環境要因の全容を解明する必要があります。
ヒトの遺伝情報はほとんどが共通していますが、0.1%程度の個人差(多型性)があることが知られています。その個人差の一つである一塩基の変異による多型は一塩基多型(SNP)と呼ばれ、疾患との関連について今日まで多くの研究が行われてきました。特に、2000年代後半からはマイクロアレイ*4を用いてゲノム全体を網羅するSNP解析(GWAS*5)が可能となりました。ベーチェット病では、2010年に水木信久主任教授らのグループが行ったGWASにより、新規の疾患感受性遺伝子としてIL10およびIL23R-IL12RB2の2遺伝子領域が世界で初めて報告されました。その後、他の報告によって、ベーチェット病の疾患感受性遺伝子が複数同定されてきましたが、ベーチェット病の遺伝要因および発症メカニズムの全容は依然として解明されていませんでした。近年、様々な疾患のGWASの結果をもとにして、免疫に関連する遺伝子領域を特異的かつ高密度に解析することができるマイクロアレイ(Immunochip、イルミナ社)が開発され、これによって他の免疫関連疾患で新たに多くの疾患感受性遺伝子が同定されています。
研究の内容
Immunochipを用いたベーチェット病の遺伝子解析を行うため、日本・アメリカ・トルコ・ポルトガル・イランの5カ国に及ぶ国際共同研究を遂行しました。本研究では、日本人・トルコ人・イラン人集団の患者計3,477例および健常者計3,342例を用いて遺伝子解析を実行しました(図1)。
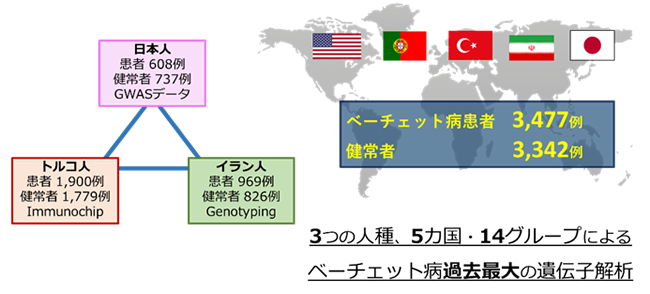
図1:本研究の研究デザイン
まず、Immunochipを用いてトルコ人集団のGWASを行ったところ、IL1A-IL1B、IRF8、CEBPB-PTPN1領域においてベーチェット病とのゲノムワイドレベルの相関(P < 5×10-8)が認められました(図2)。次に、Immunochip を用いて取得したトルコ人集団のGWASデータと2010年に水木信久主任教授らのグループが取得した日本人集団のGWASデータを結合したメタ解析を行い、RIPK2、ADO-EGR2、LACC1、IRF8領域でゲノムワイドレベルの相関が認められました。さらに、イラン人集団を用いてトルコ人データの再現性を確認したところ、ADO-EGR2、IRF8、CEBPB-PTPN1領域で再現性が確認され、トルコ人集団とのメタ解析によりゲノムワイドレベルの相関が検出されました。
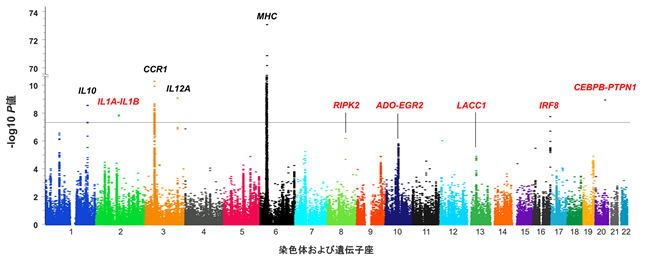
図2:本研究により見出されたヒトゲノム全域におけるSNPとベーチェット病の関連性
グラフ内に、Immunochip*3を用いて解析された約13万個のSNPをプロットした。横軸が染色体ごとのSNPの位置を示し、縦軸がベーチェット病との関連性の強さを示す。上に位置するSNPほど、ベーチェット病との関連性が強くなる。本研究によって新規に同定された疾患感受性遺伝子領域を赤字で記した。
次に、疾患と強い相関を示したIL1A-IL1B領域のSNP(rs4402765)を対象に、IL1A遺伝子およびIL1B遺伝子の機能解析を行った結果、rs4402765のリスクアリルを2個保有する人において、IL1B遺伝子からコードされるIL-1βが有意に上昇することが分かりました(図3)。IL-1βは炎症性サイトカインの一つであり、病原体に対する生体の免疫反応において重要な役割を担っています。ベーチェット病患者ではIL-1βが上昇していることや、治療にIL-1β阻害薬が有効であることが報告されており、本研究の発見はこれらの知見に沿ったものと言えます。一方、IL1A遺伝子からコードされるIL-1αはrs4402765のリスクアリルを2個保有する人において有意に低下していました(図3)。IL-1αは表皮に多く発現する炎症性サイトカインであり、皮膚での生態防御に関与しているため、リスクアリルを2個保有する人では病原体に対しての皮膚のバリア機能が弱くなっていることが示唆されます。以前より、病原体の感染がベーチェット病発症の契機になることが考えられてきましたが結論には至っていませんでした。
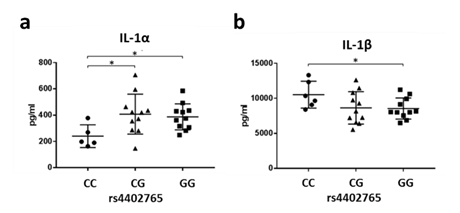
図3:健常者末梢血単核球におけるIL1A-IL1B領域のジェノタイプ(rs4402765;リスクアリルC)とタンパク質発現量。a IL-1α、b IL-1β
本研究の結果から、rs4402765のリスクアリルを2個保有する人では、バリア機能の低下によって体内に侵入した病原体に過剰な免疫応答が起き、ベーチェット病の発症につながっている可能性が示唆されました。本研究で同定された遺伝子の多くは炎症性腸疾患の一つであるクローン病と共通していました。クローン病とベーチェット病は臨床像に多くの共通点があり、本研究の結果から両疾患の遺伝的背景も近いことが分かりました。さらに興味深い事に、ベーチェット病の疾患感受性遺伝子はハンセン病とも多く共通していました。ハンセン病はらい菌による感染症であることからも、ベーチェット病の発症に病原体が関与していることが強く示唆されます。
今後の展開
本研究は過去最大の国際的なベーチェット病の遺伝子解析研究で、これによりベーチェット病発症の要因となる疾患感受性遺伝子が多数同定されました。そして、同定された疾患感受性遺伝子の機能解析により、それらの遺伝子がベーチェット病の病態にどのように関与するかが解明されました。本研究の遺伝学的成果をこれまでの遺伝学的知見と結合することで、ベーチェット病の発症に関与する遺伝要因および発症メカニズムの全容が明らかになりました。また、本研究の遺伝学的成果は、環境要因として考えられている病原体の存在がベーチェット病に強く関係していることを示唆するものであり、今後の環境要因の解明にも大いに貢献するものと考えられます。また、本研究の結果をもとに、将来的には、個人の遺伝情報に基づいた疾患の予防・予後の予測や、特定の分子を標的とした分子製剤による効果的で副作用のより少ないテーラーメイド治療の開発に繋がることが期待されます。
用語解説
*1 SNP
single nucleotide polymorphism(一塩基多型)の略。ヒトゲノムは30億塩基対のDNAからなるとされているが、個々人を比較するとそのうちの 0.1%の塩基配列に違いがあると見られており、これを遺伝子多型と呼ぶ。遺伝子多型のうち、1つの塩基が他の塩基に置き変わるものをSNPと呼ぶ。SNPは最も多く存在する遺伝子多型である。遺伝子多型のタイプにより遺伝子をもとに体内で作られるタンパク質の働きが微妙に変化し、疾患の罹り易さや医薬品への反応に変化が生じる。
*2 リスクアリル
SNPの核酸塩基のうち、疾患に感受性を示す核酸塩基のこと。
*3 Immunochip
主要な自己免疫疾患や炎症性疾患をより詳細に解析するために開発されたカスタムメイドのマイクロアレイであり、慢性関節リウマチやクローン病など12種類の免疫関連疾患のGWASデータを元に186遺伝子座に位置するSNPが網羅的にデザインされている。Immunochipを用いることで、免疫関連遺伝子領域に分布するSNPを高密度に解析することができ、GWASでは同定できなかったSNPを探索することが可能である。
*4 マイクロアレイ
ガラス製の基盤にDNAの部分配列が高密度に配置された分析器具であり、DNAチップとも呼ばれる。検体のDNAと部分配列を反応させて得られる蛍光の強度を測定することにより、数万から百万ほどのSNP情報を一度に調べることができる。
*5 GWAS
genome-wide association study(ゲノムワイド関連解析)の略。ゲノム全域を網羅する遺伝子多型(主にSNP)を対象に、ある疾患を持つ群と持たない群との間で統計学的に有意な頻度差を示す遺伝子多型を検索する手法。
掲載論文
Takeuchi M, Mizuki N, Meguro A, Ombrello MJ, Kirino Y, Satorius C, Le J, Blake M, Erer B, Kawagoe T, Ustek D, Tugal-Tutkun I, Seyahi E, Ozyazgan Y, Sousa I, Davatchi F, Francisco V, Shahram F, Abdollahi BS, Nadji A, Shafiee NM, Ghaderibarmi F, Ohno S, Ueda A, Ishigatsubo Y, Gadina M, Oliveira SA, Gül A, Kastner DL, Remmers EF. Dense genotyping of immune-related loci implicates host responses to microbial exposure in Behçet’s disease susceptibility. Nat Genet.49(3);438-443, 2017. doi: 10.1038/ng.3786
※本研究は、アメリカ国立ヒトゲノム研究所、アメリカ国立関節炎・筋骨格および皮膚疾患研究所、日本学術振興会、公益財団法人 かなえ医薬振興財団、公益財団法人 武田科学振興財団、公益財団法人 先進医薬研究振興財団、横浜生命科学振興財団、ポルトガル科学技術財団、テヘラン大学医科学研究委員会による研究助成を受けて行われました。
